Внимание: препарат GTX-102 не является зарегистрированным препаратом. Данные, представленные здесь, являются промежуточными итогами исследования. Эти данные не дают полной картины об эффективности и безопасности препарата. Требуется значительно больше времени, чтобы оценить, насколько препарат эффективен и безопасен.
GTX-102 — это антисмысловые олигонуклеотиды (ASO). Данный метод лечения меняет экспрессию РНК. При Синдроме Ангельмана отсутствует или неправильно функционирует материнская копия гена UBE3A. GTX-102 активирует отцовскую копию, которая обычно неактивна.
Данное исследование является первым испытанием ASO на людях с Синдромом Ангельмана. Протокол исследования подразумевает 4 введения препарата с интервалом в 1 месяц. Каждой группе пациентов вводится препарат в разной дозировке, но у всех групп дозировка увеличивается в течение исследования. Препарат вводится интратекально (люмбарная пункция). Исследование не плацебо — контролируемое.
Основные цели исследования:
1.оценка безопасности и фармакокинетики препарата (измерение концентрации препарата в крови и спинномозговой жидкости).
2.оценка эффективности применения у людей с СА (коммуникативные способности, поведение, крупная и мелкая моторика, эпилепсия).
Критерии включения: документально подтвержденная делеция материнской копии гена UBE3A, возраст от 4 до 17 лет, эпилепсия в ремиссии, нормальные анализы показателей работы печени и почек, способность хорошо переносить наркоз.
Критерии исключения: любое изменение диеты или замена принимаемых препаратов в предыдущие 3 месяца (включая снотворные, БАДы, введение кетогенной диеты, и т. д.); неспособность перемещаться самостоятельно или с помощью опекуна; нарушение свертываемости крови или тромбоцитопения; возможная необходимость интубации.
Для оценки результатов действия препарата GTX-102 были использованы различные методы (ЭЭГ, дневник сна и приступов, а также различные методы оценки поведения, когнитивных способностей и моторных навыков — ActiMyo, ABC, Vineland, Bayley-4).
На данный момент препарат GTX-102 был протестирован на 5 пациентах с Синдромом Ангельмана. В процессе набора дозы разница между первоначальной и конечной дозами препарата достигла 10-кратного размера (от 3,3 мг до 36 мг).
Уровень GTX-102 в крови был пропорционален дозировке. Как и ожидалось, GTX-102 не обнаруживался в крови и спинномозговой жидкости спустя 28 дней после введения.
В процессе исследования наблюдались следующие побочные эффекты:
— кратковременная атаксия и переутомление
— наблюдалось при приеме высоких доз препарата (20мг и выше)
— различная интенсивность у всех пациентов
— начало реакции отмечено через 2−6 часов после инъекции
— длительность реакции: 1−3 дня
— пациенты были способны нормально взаимодействовать и употреблять пищу во время реакции, и полностью восстановились после.
— Другие нетяжелые побочные эффекты включают головную боль, инфекцию мочеполовых путей, и другие типичные для данного возраста инфекции.
— Пациенты хорошо перенесли анестезию и люмбарную пункцию.
Безопасность: Серьезные побочные эффекты (СПЭ)
У всех 5 пациентов отмечена слабость нижних конечностей (возникла в течение 6−30 дней после последней инъекции). У 3 из 5 пациентов наблюдалась значительная слабость, а 2 из 5 пациентов временно потеряли способность ходить. У 4 пациентов данный СПЭ наблюдался после введения максимальной дозы (36 мг), и у 1 пациента после 20 мг.
Введение препарата приостановлено после того, как обнаружился первый эпизод СПЭ.
В более тяжелых случаях побочный эффект длился 1 — 3 недели. Полное избавление от данного СПЭ отмечено после 19 — 86 дней.
Важно отметить, что улучшение клинической картины Синдрома Ангельмана наблюдалось и после избавления от побочных эффектов.
Слабость нижних конечностей была вызвана воспалением нервных корешков в результате интратекального введения препарата.
Других серьезных побочных эффектов препарата GTX-102 не обнаружено.
Эффективность:
Все 5 пациентов показали улучшения во многих аспектах по шкале общего клинического впечатления. У всех пациентов отмечены значительные улучшения в 2 и более аспектах. У всех пациентов отмечены небольшие улучшения в 3 аспектах.
У пациентов отмечены улучшения экспрессивной и рецептивной речи по шкале Bayley-4. У некоторых пациентов улучшение наблюдалось после введения минимальной дозы препарата.
Перед началом исследования была разработана Шкала общего клинического впечатления для Синдрома Ангельмана:
Она отображает, насколько сильные нарушения наблюдаются у пациента в начале и в ходе исследования.
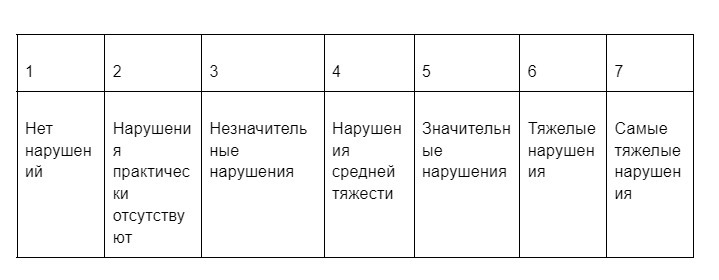
Оценивались следующие аспекты, наиболее значимые при Синдроме Ангельмана: коммуникация, сон, поведение, крупная моторика, мелкая моторика. Значение 1 — характеристика нормотипичного человека, значения 2−7 характерны для Синдрома Ангельмана.
Использовались все возможные источники информации: опрос родителей, информация из школы, видеозаписи, и т. д.
Также была разработана Шкала общего клинического улучшения, которая соответствует шкале, используемой врачами в работе (для определения эффективности лечения).
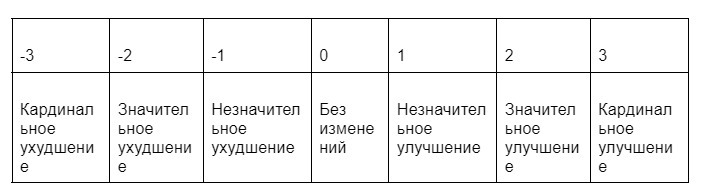
Значения могут оставаться без изменений в случае, если на момент начала исследования у пациента не было проблем в данном аспекте.
Таблица общего клинического улучшения:
Изменения, отмеченные у пациентов на 128-й день исследования (все пациенты показали положительные изменения в трех и более аспектах).
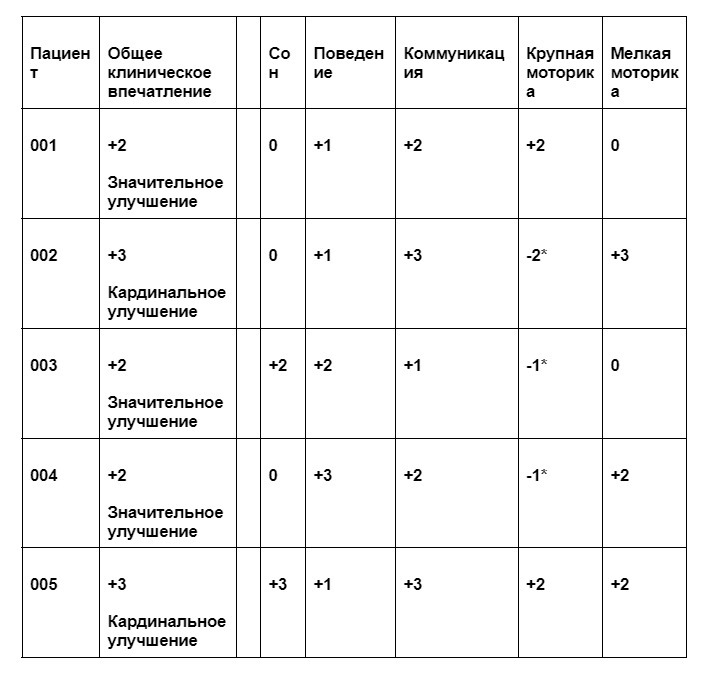
* Временная слабость нижних конечностей, вызванная воспалением.
** Значения 0 и + 1 часто обусловлены отсутствием или слабой выраженностью проблемы в данном аспекте (напр., нормальный сон, нормальное поведение).
Улучшения, отмеченные родителями пациентов (возраст пациентов 5−15 лет):
— Коммуникация:
-Приобретение новых слов (до 11 слов), знаков и жестов, улучшение навыков
использования альтернативных средств коммуникации.
-Способность откликаться на свое имя, выполнять задачи и фокусироваться
на них.
— Моторика (крупная и мелкая):
-Приобретение навыков самообслуживания (напр., еда вилкой)
-Улучшение результатов физических упражнений (напр., самостоятельное
плавание, бросание мяча)
-Улучшение походки и осанки; ходьба в гору, ходьба по песку, преодоление
бордюров, более устойчивая походка, более правильная постановка ног
— Сон:
-Кардинальное улучшение сна у пациентов с проблемным сном (один из пациентов никогда до этого не спал на протяжении всей ночи).
— Поведение:
-Снижение частоты проявлений нежелательного поведения
-Улучшение социального взаимодействия
Предварительные результаты анализа ЭЭГ мониторинга при приеме препарата GTX-102.
3 из 4 пациентов продемонстрировали снижение активности дельта-волн.
3 из 4 пациентов продемонстрировали снижение эпилептиформной активности (во время сна и бодрствования).
Рекомендован дальнейший ЭЭГ мониторинг, чтобы оценить результаты долговременного воздействия препарата.
*Эпилепсия была в ремиссии у всех пациентов, не было зафиксировано новых приступов во время исследования.
План по возобновлению клинического исследования GTX-102:
Промежуточные итоги:
— GTX-102 клинически активен в более низких дозах
— Более высокие дозы ассоциируются с риском возникновения серьезных побочных эффектов (слабость нижних конечностей)
— Данный побочный эффект, вероятно, вызван локальным воздействием GTX-102 на спинномозговые нервы.
План:
— Поменять протокол исследования
— Стартовая дозировка будет 3,3 мг и 5 мг, в зависимости от возраста пациента
— Индивидуальный набор дозы: медленно увеличивать дозировку, если нет опасений в безопасности для данного пациента.
— Установить максимальную дозировку в 14 мг, избегать 20 мг.
— Изменить процедуру введения препарата, чтобы минимизировать длительность воздействия в месте введения
Необходимо, чтобы FDA утвердило данное изменение протокола, чтобы возобновить исследование.
